Es el título del proyecto que defendieron el 12 de mayo, alumnos de 1º de bachillerato del IES LAS ENCINAS en el II Congreso de Ciencias de la Naturaleza "Cientifícate" .
 |
¿ A qué querían dar respuesta? Carlos, Iciar, Ramón, Izan, Lydia y Daniel son alumnos de 1º de bachillerato. En una clase de física y química, estaba explicando la reacción de neutralización, y como ejemplo en la pizarra escribí la reacción entre el ácido clorhídrico y el hidróxido de sodio. Esta reacción tiene como productos el cloruro de sodio (sal común) y agua. Carlos me pregunto: " Profe, ¿la sal obtenida en esta reacción es la misma que la que usamos en casa?". Le contesté que sí, aunque, la que utilizamos en casa, no se obtiene así.
Un grupo de alumnos viene los miércoles en el recreo al laboratorio de física y química, voluntariamente, a realizar pequeños experimentos. Junto con otro grupo de alumnos de 3º y 4º de ESO prepararon la semana de la ciencia que celebramos en noviembre e hicieron el árbol de navidad químico.
La pregunta que Carlos había hecho, me llamó la atención. Les propuse comprobar si la sal obtenida experimentalmente y la sal comercial eran iguales.
Aceptaron el reto y se pusieron manos a la obra. Daniel, Lydia, Izan, Ramón, Iciar y Carlos, decidieron demostrar si la sal obtenida en la reacción de neutralización era o no común.
El metodo que siguieron fue comparar algunas propiedades de la sal comercial con nuestra sal experimental. Antes de comparar tuvieron que obtener sal. Hicieron disoluciones de ácido clorhídrico y de hidróxido de sodio de concentración conocida y mezclaron ambos reactivos para obtener sal.
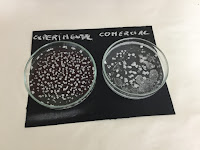
La primera propiedad que compararon fue la cristalización.
Podemos apreciar en estas dos placas que ambas muestras, experimental y comercial, cristalizaron de la misma forma. El fondo turbio en la sal comercial se debe a impurezas. Es lo que han determinado "nuestros científicos".
La segunda propiedad fue la solubilidad. Buscaron la información necesaria en la curva de solubilidad (36 g/100 g de agua), como no disponían de gran cantidad de sal experimental disolvieron un gramo de sal en 2,7 g de agua. El experimento se realizó a 20° C. El resultado también fue positivo. Nuestra sal se comportó como la sal comercial.
La medida del pH fue la tercera prueba. Tanto la sal comercial como la experimental tenían pH 7 en disolución acuosa.
 La sal disminuye el punto de fusión del agua, fue la cuarta prueba realizada. Podemos comprobar en la imagen que en ambos casos el termómetro esta por debajo de 0ºC.
La sal disminuye el punto de fusión del agua, fue la cuarta prueba realizada. Podemos comprobar en la imagen que en ambos casos el termómetro esta por debajo de 0ºC.
La quinta y última prueba fue la conductividad eléctrica.
 Sabemos que la sal en estado sólido no conduce la corriente eléctrica, pero si lo hace disuelta en agua.
Sabemos que la sal en estado sólido no conduce la corriente eléctrica, pero si lo hace disuelta en agua.
En las imágenes se comprobamos que el comportamiento de la sal obtenida experimentalmente se comporta una vez más, como la sal común comercial.
A la vista de los resultados concluyeron que la sal experimental y la sal comercial tenían el mismo comportamiento.
A lo mejor alguno lo habéis pensado, pero no, la única prueba que no se podía hacer era probar la sal experimental.
Termino con una foto de todos los participantes. Enhorabuena a todos.



No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.